一、临床试验项目伦理审查的申请与受理
工作指南
第一条 为规范开展我院伦理审查工作,指导各专业研究者和申办方提交伦理审查文件,特制定伦理审查的申请与受理工作指南。
第二条 时间安排:
(一)伦理办公室:每周二、四下午为接待日,其他时间原则上不予接待(报本院发生的 SAE/SUSAR 及特殊情况除外)。
(二)伦理相关事宜联系:[email protected],南华大学附属第一医院科研与学科建设部陈丹君,办公室电话:0734-8279018。伦理委员会名称:南华大学附属第一医院临床研究分伦理委员会。
(三)伦理委员会每月召开1次会议审查,会议时间相对固定在每月上旬第一个周二下午,必要时增加会议次数。
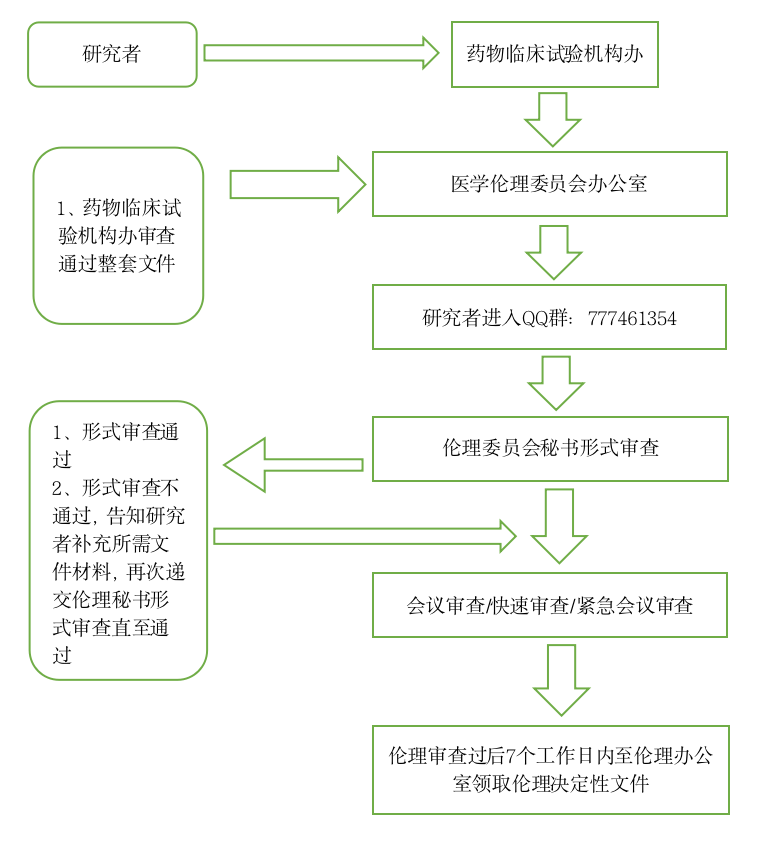
第三条 送审所需的文件清单及表格请在QQ(注册类临床试验项目77746135 4)下载。 初始审查申请人按照伦理审查清单准备资料(药物、医疗器械、诊断试剂临床试验、部分科研项目),需先在机构立项审查系统中上传资料机构系统地址:https://nhfyyygcp.wetrial.com/,由机构/科研部拟立项通过后再进入伦理审查系统审查,请注意提供给本中心的方案与知情同意书等文件均为组长单位通过的版本。注册类的初始审查均采用会议审查的方式。申办者或研究者应按照送审文件清单准备资料,至少在会议前一周将全部资料(包括纸质版和电子版资料https://nhfyyyll.wetrial.com/,完整版1份)送至伦理委员会办公室。
第四条 所有临床试验项目必须经本院药物临床试验机构办公室立项成功后,方可送伦理委员会待审。
第五条 伦理审查的类别:初始审查和复审。
第六条 范围:
(一)初始审查:拟在本院内开展的各类临床试验新项目。
(二)复审:初始审查或跟踪审查意见为“必要的修改后同意”,依据意见进行修改后,应当提交复审;对“不同意”审查意见有不同看法的,以提交复审的方式提出不同意见,请伦理委员会重新考虑决定。对“暂停/终止已同意的研究”的审查意见有不同意见,以提交复审的方式提出对已开展项目的方案知情修正、年度/定期跟踪报告、安全报告、暂停/终止已同意的研究报告、方案违背/偏离报告、受试者诉求、结题报告等的跟踪审查。复审均以“复审申请表”加“伦理意见回复函”的形式提交复审申请。
第七条 送审人:初始审查项目请在临床试验机构办公室立项成功后,由其联系人送至伦理办公室待审;复审文件,由研究者团队人员送至伦理办公室待审。
第八条 基本程序:临床试验机构办公室联系人/研究者团队人员送审文件;伦理委员会秘书与申请人确定沟通方式,伦理委员会秘书受理后进行形式审查,对于提交的审查文件资料不齐全或不符合规定要求的,告知伦理审查申请人需要补正的内容以及提交补充材料的截止日期,发送补充/修改送审材料通知;审查文件资料齐全的,发送受理通知,待审。
第九条 伦理委员会会议审查/快速审查。
第十条 缴纳伦理评审费。
初始审查费用包括税费共5500元,初审/复审/修正案快审费用包括税费共3300元,初审/复审/修正案会审包括税费共5500元。
伦理费用需在伦理会前一周打至我院账户。
户名:南华大学附属第一医院
开户行:建行衡阳分行解放路支行
账号:43001540064050002343
打款证明须备注:机构受理号,项目名称和公司名称。
第十一条 审查决定的传达:申请人在伦理审查(会议审查、快速审查)过后 7 个工作日内至伦理办公室领取伦理审查决定性文件。
第十二条 复审按照对应的审查流程进行,初审项目申请与受理流程图见下图:
临床试验项目初始伦理审查申请流程图:
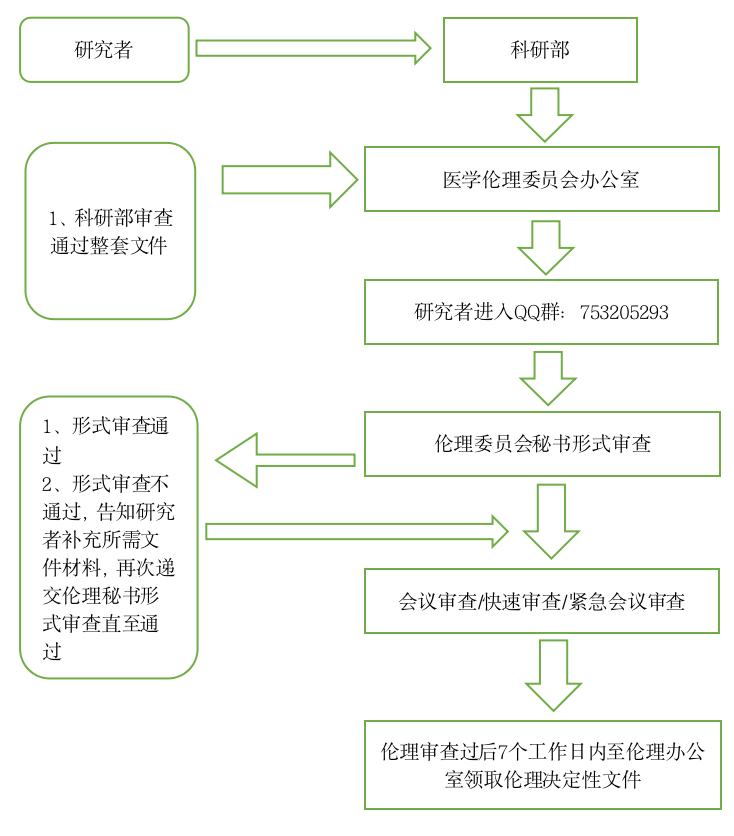
二、科研类项目伦理审查的申请与受理
工作指南
第一条 为规范开展我院伦理工作,指导各专业研究者和资助方人员提交科研伦理审查文件,特制定科研伦理审查的申请与受理的工作指南。
第二条 时间安排:
(一)伦理办公室:每周二、四下午为接待日,其他时间原则上不予接待(报本院发生的 SAE/SUSAR 及特殊情况除外)。
(二)伦理委员会每月召开 1 次会议审查,会议时间相对固定在每月上旬第一个周二下午,必要时增加会议次数。
第三条 送审文件:送审所需的文件清单及表格请在QQ(科研类临床研究项目753205293)下载。 初始审查申请人按照伦理审查清单准备资料,需先在机构立项审查系统中上传资料科研系统地址:https://nhfyky.wetrial.com,由机构/科研部拟立项通过后再进入伦理审查系统审查。
第四条 所有科研项目均需遵循先科学审查,后伦理审查的原则;先伦理审查,后开展研究的程序。
第五条伦理审查的类别:初始审查和复审
第六条 范围:
(一)初始审查:拟/已在本院内开展的各类科研项目,如研究者发起的和各类横向和纵向课题新项目。
(二)复审:初始审查或跟踪审查意见为“必要的修改后同意”, 依据意见进行修改后,应当提交复审;对“不同意”审查意见有不同看法的,以提交复审的方式提出不同意见,请伦理委员会重新考虑决定。对“暂停/终止已同意的研究”的审查意见有不同意见,以提交复审的方式提出。已开展项目的方案知情修正、年度/定期跟踪报告、安全性报告、暂停/终止已同意的研究报告、结题报告等跟踪审查。
复审均以“复审申请表”加“伦理意见回复函”的形式提交复审申请。
第七条 送审人:初次审查项目请先与我院相关管理部门接洽立项,项目立项成功后,由相关管理部门联系人/研究者再送至伦理办公室待审;复审文件,由研究者送至伦理办公室待审。
第八条 基本程序:相关管理部门联系人/研究者送审文件;伦理委员会秘书与申请人确定沟通方式,伦理委员会秘书接收后进行形式审查,对于提交的审查文件资料不齐全或不符合规定要求的,告知伦理审查申请人需要补正的内容以及提交补充材料的截止日期,发送补充/修改送审材料通知;审查文件资料齐全的,发送受理通知,待审。
第九条 伦理委员会会议审查/简易审查。
第十条 审查决定的传达:申请人在伦理审查(会议审查、简易审查)过后7个工作日内至伦理办公室领取伦理审查决定性文件。
第十一条 初审项目申请与受理流程图,见下图:
科研项目初始伦理审查申请流程图